جدول عناصر شیمیایی بر اساس عدد اتمی است . رنگها بر اساس نوع عنصر طبقهبندی شدهاند . در این جدول همچنین شماره گروه و دوره ، جرم اتمی ، چگالی ، ایزوتوپ ، فراوانی ،الکترونگاتیویته ، دمای جوش و دمای ذوب آورده شده است . این فهرست مرجعی جزئی و سریع برای عناصر محسوب میگردد ؛ لذا برای کسب اطلاعات بیشتر منابع تاییدشده آیوپاک را مطالعه فرمایید .
محتویات
[نهفتن]
کلید[ویرایش]
توضیحات بیشتر[ویرایش]
- اعداد ارائهشده در بخش چگالی ، در شرایط متعارفی فشار و دما گزارش شده است .
- اطلاعات ارائهشده در مقالات عناصر در ویکیپدیا باید با اطلاعات این جدول همخوانی داشته باشد .
طبقهبندی بر اساس نوع عنصر به تفکیک رنگ[ویرایش]
| فلزات | شبهفلزها | نافلزها | نامعلوم | |||||||
| فلزات قلیایی | فلزات قلیایی خاکی | فلزات واسطه درونی | فلزات واسطه | دیگر فلزات | دیگر نافلزات | هالوژنها | گازهای نجیب | |||
| لانتانیدها | اکتینیدها | |||||||||
راهنمای عنوان ستونها[ویرایش]
Z همان عدد اتمی ، Sym همان نشان شیمیایی ، Name همان نام عنصر ، Grp همان گروههای جدول تناوبی ، Prd همان دوره (شیمی)، Weight همان جرم اتمی ، Density همان چگالی (گرم بر سانتیمتر مربع)، Melt همان دمای ذوب با واحد کلوین ، Boil همان نقطه جوش با واحد کلوین ، Heat همان ظرفیت گرمایی با واحد (ژول بر گرم کلوین) ، Neg همان الکترونگاتیوی و Abund همان فراوانی عنصر در زمین با واحد ppm وزنی است .
فهرست[ویرایش]
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ۱ | H | هیدروژن | ۱ | ۱ | ۱٫۰۰۷۹۴(۷)۲ ۳ ۴ | ۰٫۰۰۰۰۸۹۸۸ | ۱۴٫۱۷۵ | ۲۰٫۲۸ | ۱۴٫۳۰۴ | ۲٫۲۰ | ۱۴۰۰ |
| ۲ | He | هلیم | ۱۸ | ۱ | ۴٫۰۰۲۶۰۲(۲)۲ ۴ | ۰٫۰۰۰۱۷۸۵ | n/a۶ | ۴٫۲۲ | ۵٫۱۹۳ | - | ۰٫۰۰۸ |
| ۳ | Li | لیتیم | ۱ | ۲ | ۶٫۹۴۱(۲)الگو:Refef | ۰٫۵۳۴ | ۴۵۳٫۸۵ | ۱۶۱۵ | ۳٫۵۸۲ | ۰٫۹۸ | ۲۰ |
| ۴ | Be | بریلیوم | ۲ | ۲ | ۹٫۰۱۲۱۸۲(۳) | ۱٫۸۵ | ۱۵۶۰٫۱۵ | ۲۷۴۲ | ۱٫۸۲۵ | ۱٫۵۷ | ۲٫۸ |
| ۵ | B | بور | ۱۳ | ۲ | ۱۰٫۸۱۱(۷)۲ ۳ ۴ | ۲٫۳۴ | ۲۵۷۳٫۱۵ | ۴۲۰۰ | ۱٫۰۲۶ | ۲٫۰۴ | ۱۰ |
| ۶ | C | کربن | ۱۴ | ۲ | ۱۲٫۰۱۰۷(۸)۲ ۴ | ۲٫۲۶۷ | ۳۹۴۸٫۱۵۷ | ۴۳۰۰ | ۰٫۷۰۹ | ۲٫۵۵ | ۲۰۰ |
| ۷ | N | نیتروژن | ۱۵ | ۲ | ۱۴٫۰۰۶۷(۲)۲ ۴ | ۰٫۰۰۱۲۵۰۶ | ۶۳٫۲۹ | ۷۷٫۳۶ | ۱٫۰۴ | ۳٫۰۴ | ۱۹ |
| ۸ | O | اکسیژن | ۱۶ | ۲ | ۱۵٫۹۹۹۴(۳)۲ ۴ | ۰٫۰۰۱۴۲۹ | ۵۰٫۵ | ۹۰٫۲۰ | ۰٫۹۱۸ | ۳٫۴۴ | ۴۶۱۰۰۰ |
| ۹ | F | فلوئور | ۱۷ | ۲ | ۱۸٫۹۹۸۴۰۳۲(۵) | ۰٫۰۰۱۶۹۶ | ۵۳٫۶۳ | ۸۵٫۰۳ | ۰٫۸۲۴ | ۳٫۹۸ | ۵۸۵ |
| ۱۰ | Ne | نئون | ۱۸ | ۲ | ۲۰٫۱۷۹۷(۶)۲ ۳ | ۰٫۰۰۰۸۹۹۹ | ۲۴٫۷۰۳ | ۲۷٫۰۷ | ۱٫۰۳ | - | ۰٫۰۰۵ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۱۱ | Na | سدیم | ۱ | ۳ | ۲۲٫۹۸۹۷۶۹۲۸(۲) | ۰٫۹۷۱ | ۳۷۱٫۱۵ | ۱۱۵۶ | ۱٫۲۲۸ | ۰٫۹۳ | ۲۳۶۰۰ |
| ۱۲ | Mg | منیزیم | ۲ | ۳ | ۲۴٫۳۰۵۰(۶) | ۱٫۷۳۸ | ۹۲۳٫۱۵ | ۱۳۶۳ | ۱٫۰۲۳ | ۱٫۳۱ | ۲۳۳۰۰ |
| ۱۳ | Al | آلومینیم | ۱۳ | ۳ | ۲۶٫۹۸۱۵۳۸۶(۸) | ۲٫۶۹۸ | ۹۳۳٫۴ | ۲۷۹۲ | ۰٫۸۹۷ | ۱٫۶۱ | ۸۲۳۰۰ |
| ۱۴ | Si | سیلیسیم | ۱۴ | ۳ | ۲۸٫۰۸۵۵(۳)۴ | ۲٫۳۲۹۶ | ۱۶۸۳٫۱۵ | ۳۵۳۸ | ۰٫۷۰۵ | ۱٫۹ | ۲۸۲۰۰۰ |
| ۱۵ | P | فسفر | ۱۵ | ۳ | ۳۰٫۹۷۳۷۶۲(۲) | ۱٫۸۲ | ۳۱۷٫۲۵ | ۵۵۳ | ۰٫۷۶۹ | ۲٫۱۹ | ۱۰۵۰ |
| ۱۶ | S | گوگرد | ۱۶ | ۳ | ۳۲٫۰۶۵(۵)۲ ۴ | ۲٫۰۶۷ | ۳۸۸٫۵۱ | ۷۱۷٫۸ | ۰٫۷۱ | ۲٫۵۸ | ۳۵۰ |
| ۱۷ | Cl | کلر | ۱۷ | ۳ | ۳۵٫۴۵۳(۲)۲ ۳ ۴ | ۰٫۰۰۳۲۱۴ | ۱۷۲٫۳۱ | ۲۳۹٫۱۱ | ۰٫۴۷۹ | ۳٫۱۶ | ۱۴۵ |
| ۱۸ | Ar | آرگون | ۱۸ | ۳ | ۳۹٫۹۴۸(۱)۲ ۴ | ۰٫۰۰۱۷۸۳۷ | ۸۳٫۹۶ | ۸۷٫۳۰ | ۰٫۵۲ | - | ۳٫۵ |
| ۱۹ | K | پتاسیم | ۱ | ۴ | ۳۹٫۰۹۸۳(۱) | ۰٫۸۶۲ | ۳۳۶٫۵ | ۱۰۳۲ | ۰٫۷۵۷ | ۰٫۸۲ | ۲۰۹۰۰ |
| ۲۰ | Ca | کلسیم | ۲ | ۴ | ۴۰٫۰۷۸(۴)۲ | ۱٫۵۴ | ۱۱۱۲٫۱۵ | ۱۷۵۷ | ۰٫۶۴۷ | ۱ | ۴۱۵۰۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۲۱ | Sc | اسکاندیم | ۳ | ۴ | ۴۴٫۹۵۵۹۱۲(۶) | ۲٫۹۸۹ | ۱۸۱۲٫۱۵ | ۳۱۰۹ | ۰٫۵۶۸ | ۱٫۳۶ | ۲۲ |
| ۲۲ | Ti | تیتانیم | ۴ | ۴ | ۴۷٫۸۶۷(۱) | ۴٫۵۴ | ۱۹۳۳٫۱۵ | ۳۵۶۰ | ۰٫۵۲۳ | ۱٫۵۴ | ۵۶۵۰ |
| ۲۳ | V | وانادیم | ۵ | ۴ | ۵۰٫۹۴۱۵(۱) | ۶٫۱۱ | ۲۱۷۵٫۱۵ | ۳۶۸۰ | ۰٫۴۸۹ | ۱٫۶۳ | ۱۲۰ |
| ۲۴ | Cr | کروم | ۶ | ۴ | ۵۱٫۹۹۶۱(۶) | ۷٫۱۵ | ۲۱۳۰٫۱۵ | ۲۹۴۴ | ۰٫۴۴۹ | ۱٫۶۶ | ۱۰۲ |
| ۲۵ | Mn | منگنز | ۷ | ۴ | ۵۴٫۹۳۸۰۴۵(۵) | ۷٫۴۴ | ۱۵۱۹٫۱۵ | ۲۳۳۴ | ۰٫۴۷۹ | ۱٫۵۵ | ۹۵۰ |
| ۲۶ | Fe | آهن | ۸ | ۴ | ۵۵٫۸۴۵(۲) | ۷٫۸۷۴ | ۱۸۰۸٫۱۵ | ۳۱۳۴ | ۰٫۴۴۹ | ۱٫۸۳ | ۵۶۳۰۰ |
| ۲۷ | Co | کبالت | ۹ | ۴ | ۵۸٫۹۳۳۱۹۵(۵) | ۸٫۸۶ | ۱۷۶۸٫۱۵ | ۳۲۰۰ | ۰٫۴۲۱ | ۱٫۸۸ | ۲۵ |
| ۲۸ | Ni | نیکل | ۱۰ | ۴ | ۵۸٫۶۹۳۴(۴) | ۸٫۹۱۲ | ۱۷۲۶٫۱۵ | ۳۱۸۶ | ۰٫۴۴۴ | ۱٫۹۱ | ۸۴ |
| ۲۹ | Cu | مس | ۱۱ | ۴ | ۶۳٫۵۴۶(۳)۴ | ۸٫۹۶ | ۱۳۵۷٫۷۵ | ۲۸۳۵ | ۰٫۳۸۵ | ۱٫۹ | ۶۰ |
| ۳۰ | Zn | روی | ۱۲ | ۴ | ۶۵٫۳۸(۲) | ۷٫۱۳۴ | ۶۹۲٫۸۸ | ۱۱۸۰ | ۰٫۳۸۸ | ۱٫۶۵ | ۷۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۳۱ | Ga | گالیم | ۱۳ | ۴ | ۶۹٫۷۲۳(۱) | ۵٫۹۰۷ | ۳۰۲٫۹۱ | ۲۴۷۷ | ۰٫۳۷۱ | ۱٫۸۱ | ۱۹ |
| ۳۲ | Ge | ژرمانیم | ۱۴ | ۴ | ۷۲٫۶۴(۱) | ۵٫۳۲۳ | ۱۲۱۱٫۴۵ | ۳۱۰۶ | ۰٫۳۲ | ۲٫۰۱ | ۱٫۵ |
| ۳۳ | As | آرسنیک | ۱۵ | ۴ | ۷۴٫۹۲۱۶۰(۲) | ۵٫۷۷۶ | ۱۰۹۰٫۱۵۷ | ۸۸۷ | ۰٫۳۲۹ | ۲٫۱۸ | ۱٫۸ |
| ۳۴ | Se | سلنیم | ۱۶ | ۴ | ۷۸٫۹۶(۳)۴ | ۴٫۸۰۹ | ۴۹۴٫۱۵ | ۹۵۸ | ۰٫۳۲۱ | ۲٫۵۵ | ۰٫۰۵ |
| ۳۵ | Br | برم | ۱۷ | ۴ | ۷۹٫۹۰۴(۱) | ۳٫۱۲۲ | ۲۶۶٫۰۵ | ۳۳۲٫۰ | ۰٫۴۷۴ | ۲٫۹۶ | ۲٫۴ |
| ۳۶ | Kr | کریپتون | ۱۸ | ۴ | ۸۳٫۷۹۸(۲)۲ ۳ | ۰٫۰۰۳۷۳۳ | ۱۱۵٫۹۳ | ۱۱۹٫۹۳ | ۰٫۲۴۸ | ۳ | <۰٫۰۰۱ |
| ۳۷ | Rb | روبیدیم | ۱ | ۵ | ۸۵٫۴۶۷۸(۳)۲ | ۱٫۵۳۲ | ۳۱۲٫۷۹ | ۹۶۱ | ۰٫۳۶۳ | ۰٫۸۲ | ۹۰ |
| ۳۸ | Sr | استرانسیم | ۲ | ۵ | ۸۷٫۶۲(۱)۲ ۴ | ۲٫۶۴ | ۱۰۴۲٫۱۵ | ۱۶۵۵ | ۰٫۳۰۱ | ۰٫۹۵ | ۳۷۰ |
| ۳۹ | Y | ایتریم | ۳ | ۵ | ۸۸٫۹۰۵۸۵(۲) | ۴٫۴۶۹ | ۱۷۹۹٫۱۵ | ۳۶۰۹ | ۰٫۲۹۸ | ۱٫۲۲ | ۳۳ |
| ۴۰ | Zr | زیرکونیم | ۴ | ۵ | ۹۱٫۲۲۴(۲)۲ | ۶٫۵۰۶ | ۲۱۲۵٫۱۵ | ۴۶۸۲ | ۰٫۲۷۸ | ۱٫۳۳ | ۱۶۵ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۴۱ | Nb | نیوبیم | ۵ | ۵ | ۹۲٫۹۰۶۳۸(۲) | ۸٫۵۷ | ۲۷۴۱٫۱۵ | ۵۰۱۷ | ۰٫۲۶۵ | ۱٫۶ | ۲۰ |
| ۴۲ | Mo | مولیبدن | ۶ | ۵ | ۹۵٫۹۶(۲)۲ | ۱۰٫۲۲ | ۲۸۹۰٫۱۵ | ۴۹۱۲ | ۰٫۲۵۱ | ۲٫۱۶ | ۱٫۲ |
| ۴۳ | Tc | تکنسیم | ۷ | ۵ | [۹۸]۱ | ۱۱٫۵ | ۲۴۷۳٫۱۵ | ۵۱۵۰ | - | ۱٫۹ | <۰٫۰۰۱ |
| ۴۴ | Ru | روتنیم | ۸ | ۵ | ۱۰۱٫۰۷(۲)۲ | ۱۲٫۳۷ | ۲۵۲۳٫۱۵ | ۴۴۲۳ | ۰٫۲۳۸ | ۲٫۲ | ۰٫۰۰۱ |
| ۴۵ | Rh | رودیم | ۹ | ۵ | ۱۰۲٫۹۰۵۵۰(۲) | ۱۲٫۴۱ | ۲۲۳۹٫۱۵ | ۳۹۶۸ | ۰٫۲۴۳ | ۲٫۲۸ | ۰٫۰۰۱ |
| ۴۶ | Pd | پالادیم | ۱۰ | ۵ | ۱۰۶٫۴۲(۱)۲ | ۱۲٫۰۲ | ۱۸۲۵٫۱۵ | ۳۲۳۶ | ۰٫۲۴۴ | ۲٫۲ | ۰٫۰۱۵ |
| ۴۷ | Ag | نقره | ۱۱ | ۵ | ۱۰۷٫۸۶۸۲(۲)۲ | ۱۰٫۵۰۱ | ۱۲۳۴٫۱۵ | ۲۴۳۵ | ۰٫۲۳۵ | ۱٫۹۳ | ۰٫۰۷۵ |
| ۴۸ | Cd | کادمیم | ۱۲ | ۵ | ۱۱۲٫۴۱۱(۸)۲ | ۸٫۶۹ | ۵۹۴٫۳۳ | ۱۰۴۰ | ۰٫۲۳۲ | ۱٫۶۹ | ۰٫۱۵۹ |
| ۴۹ | In | ایندیم | ۱۳ | ۵ | ۱۱۴٫۸۱۸(۳) | ۷٫۳۱ | ۴۲۹٫۹۱ | ۲۳۴۵ | ۰٫۲۳۳ | ۱٫۷۸ | ۰٫۲۵ |
| ۵۰ | Sn | قلع | ۱۴ | ۵ | ۱۱۸٫۷۱۰(۷)۲ | ۷٫۲۸۷ | ۵۰۵٫۲۱ | ۲۸۷۵ | ۰٫۲۲۸ | ۱٫۹۶ | ۲٫۳ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۵۱ | Sb | آنتیموان | ۱۵ | ۵ | ۱۲۱٫۷۶۰(۱)۲ | ۶٫۶۸۵ | ۹۰۴٫۰۵ | ۱۸۶۰ | ۰٫۲۰۷ | ۲٫۰۵ | ۰٫۲ |
| ۵۲ | Te | تلوریم | ۱۶ | ۵ | ۱۲۷٫۶۰(۳)۲ | ۶٫۲۳۲ | ۷۲۲٫۸ | ۱۲۶۱ | ۰٫۲۰۲ | ۲٫۱ | ۰٫۰۰۱ |
| ۵۳ | I | ید | ۱۷ | ۵ | ۱۲۶٫۹۰۴۴۷(۳) | ۴٫۹۳ | ۳۸۶٫۶۵ | ۴۵۷٫۴ | ۰٫۲۱۴ | ۲٫۶۶ | ۰٫۴۵ |
| ۵۴ | Xe | زنون | ۱۸ | ۵ | ۱۳۱٫۲۹۳(۶)۲ ۳ | ۰٫۰۰۵۸۸۷ | ۱۶۱٫۴۵ | ۱۶۵٫۰۳ | ۰٫۱۵۸ | ۲٫۶ | <۰٫۰۰۱ |
| ۵۵ | Cs | سزیم | ۱ | ۶ | ۱۳۲٫۹۰۵۴۵۱۹(۲) | ۱٫۸۷۳ | ۳۰۱٫۷ | ۹۴۴ | ۰٫۲۴۲ | ۰٫۷۹ | ۳ |
| ۵۶ | Ba | باریم | ۲ | ۶ | ۱۳۷٫۳۲۷(۷) | ۳٫۵۹۴ | ۱۰۰۲٫۱۵ | ۲۱۷۰ | ۰٫۲۰۴ | ۰٫۸۹ | ۴۲۵ |
| ۵۷ | La | لانتان | ۶ | ۱۳۸٫۹۰۵۴۷(۷)۲ | ۶٫۱۴۵ | ۱۱۹۳٫۱۵ | ۳۷۳۷ | ۰٫۱۹۵ | ۱٫۱ | ۳۹ | |
| ۵۸ | Ce | سریم | ۶ | ۱۴۰٫۱۱۶(۱)۲ | ۶٫۷۷ | ۱۰۷۱٫۱۵ | ۳۷۱۶ | ۰٫۱۹۲ | ۱٫۱۲ | ۶۶٫۵ | |
| ۵۹ | Pr | پرازئودیمیم | ۶ | ۱۴۰٫۹۰۷۶۵(۲) | ۶٫۷۷۳ | ۱۲۰۴٫۱۵ | ۳۷۹۳ | ۰٫۱۹۳ | ۱٫۱۳ | ۹٫۲ | |
| ۶۰ | Nd | نئودیمیم | ۶ | ۱۴۴٫۲۴۲(۳)۲ | ۷٫۰۰۷ | ۱۲۸۹٫۱۵ | ۳۳۴۷ | ۰٫۱۹ | ۱٫۱۴ | ۴۱٫۵ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۶۱ | Pm | پرومتیم | ۶ | [۱۴۵]۱ | ۷٫۲۶ | ۱۲۰۴٫۱۵ | ۳۲۷۳ | - | - | <۰٫۰۰۱ | |
| ۶۲ | Sm | ساماریم | ۶ | ۱۵۰٫۳۶(۲)۲ | ۷٫۵۲ | ۱۳۴۵٫۱۵ | ۲۰۶۷ | ۰٫۱۹۷ | ۱٫۱۷ | ۷٫۰۵ | |
| ۶۳ | Eu | یوروپیم | ۶ | ۱۵۱٫۹۶۴(۱)۲ | ۵٫۲۴۳ | ۱۰۹۵٫۱۵ | ۱۸۰۲ | ۰٫۱۸۲ | ۱٫۲ | ۲ | |
| ۶۴ | Gd | گادولینیم | ۶ | ۱۵۷٫۲۵(۳)۲ | ۷٫۸۹۵ | ۱۵۸۵٫۱۵ | ۳۵۴۶ | ۰٫۲۳۶ | ۱٫۲ | ۶٫۲ | |
| ۶۵ | Tb | تربیم | ۶ | ۱۵۸٫۹۲۵۳۵(۲) | ۸٫۲۲۹ | ۱۶۳۰٫۱۵ | ۳۵۰۳ | ۰٫۱۸۲ | ۱٫۲ | ۱٫۲ | |
| ۶۶ | Dy | دیسپروزیم | ۶ | ۱۶۲٫۵۰۰(۱)۲ | ۸٫۵۵ | ۱۶۸۰٫۱۵ | ۲۸۴۰ | ۰٫۱۷ | ۱٫۲۲ | ۵٫۲ | |
| ۶۷ | Ho | هولمیم | ۶ | ۱۶۴٫۹۳۰۳۲(۲) | ۸٫۷۹۵ | ۱۷۴۳٫۱۵ | ۲۹۹۳ | ۰٫۱۶۵ | ۱٫۲۳ | ۱٫۳ | |
| ۶۸ | Er | اربیم | ۶ | ۱۶۷٫۲۵۹(۳)۲ | ۹٫۰۶۶ | ۱۷۹۵٫۱۵ | ۳۵۰۳ | ۰٫۱۶۸ | ۱٫۲۴ | ۳٫۵ | |
| ۶۹ | Tm | تولیم | ۶ | ۱۶۸٫۹۳۴۲۱(۲) | ۹٫۳۲۱ | ۱۸۱۸٫۱۵ | ۲۲۲۳ | ۰٫۱۶ | ۱٫۲۵ | ۰٫۵۲ | |
| ۷۰ | Yb | ایتربیم | ۶ | ۱۷۳٫۰۵۴(۵)۲ | ۶٫۹۶۵ | ۱۰۹۷٫۱۵ | ۱۴۶۹ | ۰٫۱۵۵ | ۱٫۱ | ۳٫۲ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۷۱ | Lu | لوتتیم | ۳ | ۶ | ۱۷۴٫۹۶۶۸(۱)۲ | ۹٫۸۴ | ۱۹۳۶٫۱۵ | ۳۶۷۵ | ۰٫۱۵۴ | ۱٫۲۷ | ۰٫۸ |
| ۷۲ | Hf | هافنیم | ۴ | ۶ | ۱۷۸٫۴۹(۲) | ۱۳٫۳۱ | ۲۵۰۰٫۱۵ | ۴۸۷۶ | ۰٫۱۴۴ | ۱٫۳ | ۳ |
| ۷۳ | Ta | تانتال | ۵ | ۶ | ۱۸۰٫۹۴۷۸۸(۲) | ۱۶٫۶۵۴ | ۳۲۶۹٫۱۵ | ۵۷۳۱ | ۰٫۱۴ | ۱٫۵ | ۲ |
| ۷۴ | W | تنگستن | ۶ | ۶ | ۱۸۳٫۸۴(۱) | ۱۹٫۲۵ | ۳۶۸۰٫۱۵ | ۵۸۲۸ | ۰٫۱۳۲ | ۲٫۳۶ | ۱٫۳ |
| ۷۵ | Re | رنیوم | ۷ | ۶ | ۱۸۶٫۲۰۷(۱) | ۲۱٫۰۲ | ۳۴۵۳٫۱۵ | ۵۸۶۹ | ۰٫۱۳۷ | ۱٫۹ | <۰٫۰۰۱ |
| ۷۶ | Os | اسمیم | ۸ | ۶ | ۱۹۰٫۲۳(۳)۲ | ۲۲٫۶۱ | ۳۳۰۰٫۱۵ | ۵۲۸۵ | ۰٫۱۳ | ۲٫۲ | ۰٫۰۰۲ |
| ۷۷ | Ir | ایریدیم | ۹ | ۶ | ۱۹۲٫۲۱۷(۳) | ۲۲٫۵۶ | ۲۷۱۶٫۱۵ | ۴۷۰۱ | ۰٫۱۳۱ | ۲٫۲ | ۰٫۰۰۱ |
| ۷۸ | Pt | پلاتین | ۱۰ | ۶ | ۱۹۵٫۰۸۴(۹) | ۲۱٫۴۶ | ۲۰۴۵٫۱۵ | ۴۰۹۸ | ۰٫۱۳۳ | ۲٫۲۸ | ۰٫۰۰۵ |
| ۷۹ | Au | طلا | ۱۱ | ۶ | ۱۹۶٫۹۶۶۵۶۹(۴) | ۱۹٫۲۸۲ | ۱۳۳۷٫۷۳ | ۳۱۲۹ | ۰٫۱۲۹ | ۲٫۵۴ | ۰٫۰۰۴ |
| ۸۰ | Hg | جیوه | ۱۲ | ۶ | ۲۰۰٫۵۹(۲) | ۱۳٫۵۳۳۶ | ۲۳۴٫۴۳ | ۶۳۰ | ۰٫۱۴ | ۲ | ۰٫۰۸۵ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۸۱ | Tl | تالیم | ۱۳ | ۶ | ۲۰۴٫۳۸۳۳(۲) | ۱۱٫۸۵ | ۵۷۷٫۱۵ | ۱۷۴۶ | ۰٫۱۲۹ | ۱٫۶۲ | ۰٫۸۵ |
| ۸۲ | Pb | سرب | ۱۴ | ۶ | ۲۰۷٫۲(۱)۲ ۴ | ۱۱٫۳۴۲ | ۶۰۰٫۷۵ | ۲۰۲۲ | ۰٫۱۲۹ | ۲٫۳۳ | ۱۴ |
| ۸۳ | Bi | بیسموت | ۱۵ | ۶ | ۲۰۸٫۹۸۰۴۰(۱) | ۹٫۸۰۷ | ۵۴۴٫۶۷ | ۱۸۳۷ | ۰٫۱۲۲ | ۲٫۰۲ | ۰٫۰۰۹ |
| ۸۴ | Po | پولونیم | ۱۶ | ۶ | [۲۱۰]۱ | ۹٫۳۲ | ۵۲۷٫۱۵ | ۱۲۳۵ | - | ۲ | <۰٫۰۰۱ |
| ۸۵ | At | استاتین | ۱۷ | ۶ | [۲۱۰]۱ | ۷ | ۵۷۵٫۱۵ | ۶۱۰ | - | ۲٫۲ | <۰٫۰۰۱ |
| ۸۶ | Rn | رادون | ۱۸ | ۶ | [۲۲۲]۱ | ۰٫۰۰۹۷۳ | ۲۰۲٫۱۵ | ۲۱۱٫۳ | ۰٫۰۹۴ | - | <۰٫۰۰۱ |
| ۸۷ | Fr | فرانسیم | ۱ | ۷ | [۲۲۳]۱ | ۱٫۸۷ | ۳۰۰٫۱۵ | ۹۵۰ | - | ۰٫۷ | <۰٫۰۰۱ |
| ۸۸ | Ra | رادیم | ۲ | ۷ | [۲۲۶]۱ | ۵٫۵ | ۹۷۳٫۱۵ | ۲۰۱۰ | - | ۰٫۹ | <۰٫۰۰۱ |
| ۸۹ | Ac | اکتینیم | ۷ | [۲۲۷]۱ | ۱۰٫۰۷ | ۱۳۲۳٫۱۵ | ۳۴۷۱ | ۰٫۱۲ | ۱٫۱ | <۰٫۰۰۱ | |
| ۹۰ | Th | توریم | ۷ | ۲۳۲٫۰۳۸۰۶(۲)۱ ۲ | ۱۱٫۷۲ | ۲۰۲۸٫۱۵ | ۵۰۶۱ | ۰٫۱۱۳ | ۱٫۳ | ۹٫۶ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۹۱ | Pa | پروتاکتینیم | ۷ | ۲۳۱٫۰۳۵۸۸(۲)۱ | ۱۵٫۳۷ | ۱۸۷۳٫۱۵ | ۴۳۰۰ | - | ۱٫۵ | <۰٫۰۰۱ | |
| ۹۲ | U | اورانیوم | ۷ | ۲۳۸٫۰۲۸۹۱(۳)۱ | ۱۸٫۹۵ | ۱۴۰۵٫۱۵ | ۴۴۰۴ | ۰٫۱۱۶ | ۱٫۳۸ | ۲٫۷ | |
| ۹۳ | Np | نپتونیوم | ۷ | [۲۳۷]۱ | ۲۰٫۴۵ | ۹۱۳٫۱۵ | ۴۲۷۳ | - | ۱٫۳۶ | <۰٫۰۰۱ | |
| ۹۴ | Pu | پلوتونیم | ۷ | [۲۴۴]۱ | ۱۹٫۸۴ | ۹۱۳٫۱۵ | ۳۵۰۱ | - | ۱٫۲۸ | <۰٫۰۰۱ | |
| ۹۵ | Am | امریسیم | ۷ | [۲۴۳]۱ | ۱۳٫۶۹ | ۱۲۶۷٫۱۵ | ۲۸۸۰ | - | ۱٫۳ | ۰۸ | |
| ۹۶ | Cm | کوریم | ۷ | [۲۴۷]۱ | ۱۳٫۵۱ | ۱۳۴۰٫۱۵ | ۳۳۸۳ | - | ۱٫۳ | ۰ | |
| ۹۷ | Bk | برکلیم | ۷ | [۲۴۷]۱ | ۱۴٫۷۹ | ۱۲۵۹٫۱۵ | ۹۸۳ | - | ۱٫۳ | ۰ | |
| ۹۸ | Cf | کالیفرنیم | ۷ | [۲۵۱]۱ | ۱۵٫۱ | ۱۹۲۵٫۱۵ | ۱۱۷۳ | - | ۱٫۳ | ۰ | |
| ۹۹ | Es | اینشتینیم | ۷ | [۲۵۲]۱ | ۱۳٫۵ | ۱۱۳۳٫۱۵ | - | - | ۱٫۳ | ۰ | |
| ۱۰۰ | Fm | فرمیم | ۷ | [۲۵۷]۱ | - | - | - | - | ۱٫۳ | ۰ | |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۱۰۱ | Md | مندلیفیم | ۷ | [۲۵۸]۱ | - | - | - | - | ۱٫۳ | ۰ | |
| ۱۰۲ | No | نوبلیم | ۷ | [۲۵۹]۱ | - | - | - | - | ۱٫۳ | ۰ | |
| ۱۰۳ | Lr | لارنسیم | ۳ | ۷ | [۲۶۲]۱ | - | - | - | - | ۱٫۳ | ۰ |
| ۱۰۴ | Rf | رادرفوردیم | ۴ | ۷ | [۲۶۱]۱ | ۱۸٫۱ | - | - | - | - | ۰ |
| ۱۰۵ | Db | دوبنیم | ۵ | ۷ | [۲۶۲]۱ | ۳۹ | - | - | - | - | ۰ |
| ۱۰۶ | Sg | سیبورگیم | ۶ | ۷ | [۲۶۶]۱ | ۳۵ | - | - | - | - | ۰ |
| ۱۰۷ | Bh | بوریم | ۷ | ۷ | [۲۶۴]۱ | ۳۷ | - | - | - | - | ۰ |
| ۱۰۸ | Hs | هاسیم | ۸ | ۷ | [۲۶۷]۱ | ۴۱ | - | - | - | - | ۰ |
| ۱۰۹ | Mt | مایتنریم | ۹ | ۷ | [۲۶۸]۱ | ۳۵ | - | - | - | - | ۰ |
| ۱۱۰ | Ds | دارمشتادیم | ۱۰ | ۷ | [۲۷۱]۱ | - | - | - | - | - | ۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
| ۱۱۱ | Rg | رونتگنیوم | ۱۱ | ۷ | [۲۷۲]۱ | - | - | - | - | - | ۰ |
| ۱۱۲ | Cn | کوپرنیسیم | ۱۲ | ۷ | [۲۸۵]۱ | - | - | - | - | - | ۰ |
| ۱۱۳ | Uut | آنانتریوم | ۱۳ | ۷ | [۲۸۴]۱ | - | - | - | - | - | ۰ |
| ۱۱۴ | Uuq | آنانکادیوم | ۱۴ | ۷ | [۲۸۹]۱ | - | - | - | - | - | ۰ |
| ۱۱۵ | Uup | آنانپنتیوم | ۱۵ | ۷ | [۲۸۸]۱ | - | - | - | - | - | ۰ |
| ۱۱۶ | Uuh | آنانهگزیوم | ۱۶ | ۷ | [۲۹۲]۱ | - | - | - | - | - | ۰ |
| ۱۱۷ | Uus | آنانسپتیوم | ۱۷ | ۷ | [۲۹۵]۱ | - | - | - | - | - | ۰ |
| ۱۱۸ | Uuo | آناناکتیوم | ۱۸ | ۷ | [۲۹۴]۱ | - | - | - | - | - | ۰ |
| Z |
Sym |
Name |
Grp |
Prd |
Weight |
Density |
Melt |
Boil |
Heat |
Neg |
Abund |
.
جستارهای وابسته[ویرایش]
 |
دید کلی
تغییراتی که در واکنشی بر روی مواد واکنش دهنده صورت میگیرد، بطور کلی به دو نوع تغییر فیزیکی و تغییر شیمیایی ، تقسیم میشوند. در تغییر فیزیکی ، فقط حالت فیزیکی ماده تغییر مییابد. یعنی ساختار ذرههای تشکیل دهنده ماده تغییر نمیکند. بنابراین تغییر کلیه حالات ماده نظیر ذوب و انجماد و تبخیر و تصعید و غیره همچنین انحلال نمک ها و بازها در آب ، تغییر فیزیکی محسوب میشوند.
لیکن در تغییر شیمیایی ، در واقع اتصال اتمها به یکدیگر در واکنش دهنده ها دستخوش تغییر میشود و همچنین آرایش الکترونی اتمها نیز تغییر مییابد. البته باید توجه داشت که در جریان یک واکنش شیمیایی ، اتمها نه بوجود میآیند و نه از بین میروند و تنها شامل ترکیب ، تجزیه یا بازآرایی اتمهاست.
واکنش شیمیایی در واقع توصیفی برای یک تغییر شیمیایی است. واکنشهای شیمیایی ممکن است با آزاد کردن انرژی بصورت گرما ، نور یا صوت همراه باشند و تولید یک گاز ، تشکیل یک رسوب یا تغییر رنگ در پی داشته باشند.
روی دادن تغییر فیزیکی و تغییر شیمیایی بطور متوالی
البته مواردی وجود دارد که هر دو تغییر فیزیکی و شیمیایی بر روی یک پدیده ، بطور متوالی اتفاق میافتند. برای مثال ، با حرارت دادن تکه ای قند در لوله آزمایش ، ابتدا قند ذوب میشود که یک پدیده فیزیکی است. سپس به رنگ قهوه ای در میآید که نشاندهنده شروع تبدیل قند به کربن و یک پدیده شیمیایی است. در ادامه ، مقداری بخار آب به بالای لوله میرسد که نشانه تجزیه قند و ادامه پدیده شیمیایی قبل است.
پس قطرههای آب روی دیواره لوله آزمایش پدیدار میشود که نشاندهنده میعان بخار آب آزاد شده و یک پدیده فیزیکی است. در پایان ، در داخل لوله ، مادهای سیاهرنگ ، بیمزه و نامحلول در آب (برخلاف قند اولیه) باقی میماند که این ماده جدید ، زغال است و با توجه به تغییر رنگ ، مزه و حلالیت آن در آب ، نشاندهنده وقوع یک پدیده شیمیایی است.
انرژی شیمیایی
هر نوع پیوندی میان اتمهای مختلف سازنده مولکول یک جسم ، نوعی انرژی بنام در "انرژی شیمیایی" دارد که مقدار آن به نوع اتمها و نحوه قرار گرفتن آنها در مولکول بستگی دارد. در یک واکنش شیمیایی ، در واقع اتصال اتمها به یکدیگر در واکنشها دستخوش تغییر میشود و در نتیجه انرژی شیمیایی فراوردههای واکنش با انرژی شیمیایی واکنشدهندهها تفاوت پیدا میکند.
به عنوان مثال ، واکنش گاز کلر با گاز هیدروژن را در نظر بگیریم. گاز کلر از مولکولهای دو اتمی Cl2 و گاز هیدروژن از مولکولهای دو اتمی H2 تشکیل شدهاند. فراورده واکنش ، کلرید هیدروژن HCl خواهد بود که در مقایسه با واکنشدهنده با پیوندهای کاملا متفاوتی دارد و از این رو انرژی شیمیایی آنها متفاوت است.
اکنون این پرسش مطرح میشود که با توجه به متفاوت بودن انرژی شیمیایی فراوردهها و واکنشدهندهها با در نظر گرفتن "قانون پایستگی انرژی" این اختلاف انرژی به چه صورت ظاهر میشود؟
تغییر گرماگیر و تغییر گرماده
مطابق قانون پایستگی انرژی ، در هر واکنش ، باید انرژی کل ثابت بماند. بنابراین در واکنشها ، اختلاف انرژی میان فراوردهها و واکنشدهندهها به صورت گرما ظاهر میشود. از این رو ، واکنشهایی نظیر واکنشهای سوختن متان و با تشکیل کلرید هیدروژن که در آنها ، سطح انرژی فراوردههای واکنش از مواد واکنشدهنده پایینتر باشد، بعلت تولید انرژی گرمایی گرماده میگوییم و در مقابل ، واکنشهایی که در آنها سطح انرژی شیمیایی فراوردهها بیشتر از واکنشدهندهها باشد، واکنشهای گرماگیر نامیده میشوند و برای انجام چنین واکنشی باید مقداری گرما به اجزای واکنشدهنده داده شود، مانند تجزیه کردنکلرید آمونیوم جامد که با گرم کردن ، به دو گاز آمونیاک و کلرید هیدروژن تبدیل میشود.
بنابراین در اندازه گیری و محاسبه انرژی واکنشهای شیمیایی ، چیزی که همیشه محسوس و قابل اندازهگیری است، تفاوت محتوای انرژی یا بعبارتی سطح انرژی مواد اولیه و محصولات عمل است که معمولا به تغییر محتوای گرمایی ، تغییر آنتالپی گفته میشود و با ΔH نمایش میدهند و در یک واکنش گرماده خواهیم داشت:
به این ترتیب تغییر آنتالپی ΔH در یک واکنش انرژیده ، منفی است.
در یک واکنش گرماگیر خواهیم داشت:
 |
پس تغییر آنتالپی ، ΔH در یک واکنش انرژیگیر ، مثبت است.
واکنشهای شیمیایی برگشت پذیر و برگشت ناپذیر
واکنشهای برگشت ناپذیر
در این قبیل واکنشها ، محصولات واکنش بر هم اثر شیمیایی ندارند. به همین دلیل واکنش فقط در جهت رفت انجام میگیرد و تا مصرف شدن کامل واکنشدهنده پیش میرود. مثلا اگر تکهای نوار منیزیم را در ظرف محتوی HClوارد کنیم، واکنش شدیدی میان منیزیم و اسید رخ میدهد و فلز بتدریج در اسید ، حل و ناپدید میشود و همزمان با ناپدید شدن فلز ، حبابهای گاز هیدروژن درون اسید به چشم میخورند که از ظرف خارج میشوند.
بنابراین این واکنش یکطرفه است و فقط در جهت رفت پیش میرود. یعنی اگر مقداری گاز هیدروژن را در محلول کلرید وارد کنیم، هیچگونه واکنشی انجام نمیگیرد.
علاوه بر واکنش فوق ، سوختن انواع سوختها مانند بنزین ، نفت ، گاز طبیعی و... در مجاورت هوا ، محکم شدن تدریجی سیمان ، پختن تخم مرغ ، مچاله شدن نایلون در برابر شعله ، نمونههایی از واکنشهای برگشت ناپذیرند.
واکنشهای برگشت پذیر
این واکنشها در شرایط مناسب در هر دو جهت رفت و برگشت پیش میروند، مثلا اگر بخار آب را از روی گرد آهن داغ عبور دهند، اکسید آهن همراه با گاز هیدروژن پدید میآید.
و اگر گاز هیدروژن را بر اکسید آهن ( Fe3O4 ) عبور دهند، آهن و بخار آب تولید میشود. واکنش برگشت:
واکنش رفت و برگشت در مجموع یک واکنش برگشت پذیر را تشکیل میدهند و در نتیجه ، واکنش اثر بخار آب بر آهن داغ ، برگشت پذیر است. در زندگی روزانه با موارد زیادی از واکنشهای برگشت پذیر برخورد میکنیم، مانند شارژ مجدد باطری اتومبیل. مواد شیمیایی موجود در باطری خودرو هنگام تولید جریان برق بتدریج مصرف شده و به مواد دیگری تبدیل میشود. با شارژ مجدد باطری ، واکنشهای برگشت انجام میگیرند و مواد اولیه پدید میآیند.
 |
مثالهایی از فرایندهای شیمیایی
همانظور که قبلا ذکر شد، در تغییر شیمیایی ، ماهیت شیمیایی مواد تغییر مییابد و فراوردههای جدید با خواص متفاوت از مواد اولیه تولید میشود. بنابراین پدیده های زیر نمونه هایی از تغییرهای شیمیایی محسوب میشوند:
- سوختن انواع سوختها. مانند بنزین ، نفت ، گاز طبیعی و... در مجاورت هوا
- زنگ زدن فلزات
- گوارش غذا
- رسیدن میوه
- پختن غذا
- فساد مواد
- محکم شدن تدریجی سیمان.
- انحلال آمونیاک در آب. زیرا در اثر انحلال ، قسمتی از مولکولهای آمونیاک با مولکولهای آب ترکیب شده و ماده جدیدی به نام هیدروکسیدآمونیوم تولید مینمایند. بهمین دلیل که واکنش شیمیایی بین حلال و حل شونده رخ میدهد، حل شدن بیشتر جنبه شیمیایی دارد.
- لخته شدن مواد کلوئیدی. در اثر لخته شدن ، پیوندهای جدیدی تشکیل میگردد که باعث تجمع مولکولهای یک محلول کلوئیدی میشود.
انواع روش های جداسازی:
هدف از جداسازی ، حذف مزاحمتها ، غلیظ کردن محلول مورد نظر و یا سایر موارد است. برای جداسازی از اختلاف در خصوصیات فیزیکی استفاده میشود، مثل فراریت ، حلالیت و ضریب تقسیم مواد__ و ... . در آنالیز و جداسازی مواد مختلف از تکنیکهای ویژهای برحسب نوع و ساختار مواد و مخلوطها استفاده میشود که برخی از آنها که معروف بوده و حائز اهمیت بیشتری هستند، در زیر میآوریم.
تبلور:
هدف از تبلور ، جداسازی ناخالصی از اجسام جامد است. در این روش ، ابتدا جامد ناخالص را در یک حلال گرم حل میکنند، سپس محلول را صاف میکنند. ناخالصیها در فاز مایع باقی میمانند. اگر تبلور طی چند مرحله صورت گیرد، به آن تبلور جزء به جزء میگویند. در این روش انتخاب حلال از اهمیت بالایی رخوردار است. اگر از تکنیک ذوب برای جداسازی ناخالصی از جامد استفاده شود، به آن تصفیه ذوب گویند.این روش در جدا کردن ناخالصیهای ژرمانیم و اسید بتروییک کاربرد دارد. در این فرآیند ، ضریب تقسیم برابر با نسبت غلظت ناخالصی در فاز جامد به غلظت ناخالصی در فاز مایع است.
|
فرایند تبلور
|
| علوم طبیعت > شیمی > شیمی فیزیک > شیمی بلور | -->(cached) |

| تبلور یک ماده ، عبارتست از جهت یافتگی ذرهای و آرایش مولکولی و تثبیت این نظم در فضای ماده. |
تاریخچه بلورشناسی
فلاسفه قدیم نیز منشاء بلورهای یک سنگ را بلورهای یخ میدانستند که بر اثر تحمل سرمای بسیار شدید در طول مدت مدید ، طوری سخت و مقاوم شده است که میتواند حرارتهای بالاتر از صفر را هم تحمل نماید. در سال 1690 ، "Huyghens" دریافت که بلورها از اجتماع ذرات کوچکتر بوجود آمدهاند و در سال 1912 ، "M.V.Laue" توانست تئوری ساختمان شبکهای در بلورها را با استفاده از اشعه ایکس به اثبات برساند.
تبلور و نمو بلورها
تبلور معمولا در موقع تبدیل یک حالت فیزیکی به حالت فیزیکی دیگر صورت میگیرد. این تبدیل به سه صورت زیر انجام میشود:
تبلور در هنگام تبدیل حالت مایع به جامد
- انجماد مواد مذاب :
اگر ماده مذاب به سرعت سرد شود، اتمها یا مولکولها با هر موقعیتی که دارند، متراکم و بیحرکت میشوند و ماده منجمد میگردد. در این صورت جسمی جامد و ایزوتوپ بدون داشتن نظم ذرهای تشکیل میشود. اگر سرد شدن با آرامی و کند انجام شود، اتمها و مولکولها با توجه به نیروی جاذبه خود و اطاعت از شبکه تبلور کنار هم چیده شده و نطفه بلور را تشکیل میدهند. سپس در نتیجه اتصال سایر مولکولهای منزوی و معلق در ماده مذاب به نطفه بلور ، حجم آن افزایش مییابد تا اینکه به بلوری درشت تبدیل میگردد. - تبلور مواد محلول :
در این نوع تبلور باید محلول به حال فوق اشباع باشد. در چنین محلولهایی بلورها تشکیل و تهنشین میشوند. این بلورها ابتدا به صورت نطفههای متحرک میباشند، علت تحرک آنها حرکات قبلی یونها و مولکولهای سازنده آنها است. در محلولها نیز مانند انجماد مواد مذاب ، رشد بلورها از طریق اتصال منظم یونها ، اتمها و مولکولهای معلق در محلول به نطفههای بلور صورت میگیرد.
تبلور در هنگام تبدیل حالت بخار به جامدسوبلیماسیو ن
در این حالت تبلور ، بلورها مستقیما از تبدیل بخار به جامد حاصل میشوند. این بلورها معمولا کوچک و دارای طرح اولیه میباشند که اصطلاحا اسکلت بلور گفته میشود. در طبیعت ، سوبلیماسیون در گازهای خشک آتشفشانی دیده میشود. در این حالت مواد گازی آتشفشانی در شکافهای توده آذرین مستقیما به بلور تبدیل میگردند. مثال بسیار روشن برای پدیده سوبلیمانسیون ، تشکیل قشرهای بلور یخ ناشی از انجماد مستقیم بخار آب اطاقها بر روی شیشه پنجرهها در سرمای زمستان میباشد.
تبلور مواد جامد
حالت سوم تبلور که خوب شناخته نشده و در طبیعت فراوان دیده میشود، تبلور در محیط جامد است. در این حالت رشد بلورها بخرج بلورهای کوچکتر و تحت تاثیر فشار و حرارت و در مدت زمان طولانی صورت میگیرد. برای مثال امروزه سنگهای شیشهای آتشفشانی خیلی قدیمی را متبلور میبینیم. بنابراین معلوم میشود که این گونه سنگها به تدریج در طول زمان متبلور شدهاند. سنگهای آهکی دانه ریز که از بلورهای ریز کربنات کلسیم تشکیل شدهاند، تحت تاثیر عوامل دگرگونی (فشار و حرارت) به مرمر که دارای بلورهای دانه درشت کلسیت است، تبدیل میگردد.
تاثیر عوامل خارجی در نمو بلورها
شرایط زیر سبب بوجود آمدن اختلاف در اندازه بلورها میگردد:
-
سرعت انجماد :
افزایش طول مدت انجماد یک ماده مذاب امکان تغذیه شیمیایی بیشتر بلورها از ماده مذاب را فراهم میسازد. بنابراین کم شدن سرعت انجماد ، موجب تشکیل بلورهای درشت و تسریع در انجماد سبب تشکیل بلورهای کوچک و ریز میگردد. ۱-وجود مواد فرار :
وجود بخار آب و گازها در یک ماده مذاب ، نقطه انجماد را پایین آورده و سرعت انجماد را کند میسازد. بنابراین باعث افزایش رشد بلورهای آن ماده میشود. به عنوان مثال در رگههای پگماتیت به علت وجود بخار آب و گازهای فراوان در ماده مذاب پگماتیتی ، بلورها به مراتب درشتتر از بلورهای توده آذرین اصلی است، حال آنکه سرعت انجماد در رگههای پگماتیت از سرعت انجماد توده آذرین اصلی بیشتر بوده است.
۲-تراکم محلول :
اندازه بلورها در یک محلول بستگی به درجه اشباع شدگی آن محلول دارد. در محلولهای فوق اشباع تعداد مراکز تبلور فراوان میباشد و در نتیجه اندازه بلورها کوچک خواهد شد. برعکس در محلولهائی با درجه اشباع شدگی کمتر تعداد مراکز تبلور کم بوده و بنابراین اندازه بلورها درشتتر خواهد بود.
میانبار یا ادخال در بلورها
در حین رشد بلور ممکن است موادی به صورت جامد ، مایع و یا گاز به سطح بلور بچسبد. ادامه رشد بلور باعث میشود که این مواد در درون بلور قرار گرفته، موجب تشکیل ادخال در داخل بلور گردد، حبابهایی خیلی کوچک گاز کربنیک همراه با آب در داخل بلور کوارتز و یا قطرات خیلی کوچک آب در بلورهای نمک طعام و نیز قطرات مواد مذاب غیر متبلور (شیشه) در درون بلورهای فلدسپات ادخالهائی میباشند که همزمان با تبلور بلور در داخل آن قرار میگیرند.
اجتماع بلورها
اجتماع بلورها به دو صورت اجتماع منظم و نامنظم مشاهده میشود:
-
اجتماع نامنظم :
در این نوع ، اجتماع بلورها در جهات مختلف بدون رعایت نظم و ترتیب صورت میگیرد. مثلا در یک توده نبات یا در اختلاط گچ زنده با آب میبینیم که گچ میبندد. سخت و یکپارچه شدن این ماده به علت تبلور مجدد بلورهای ژیپس و چسبیدن آنها به یکدیگر صورت میگیرد. -
اجتماع منظم :
هرگاه در زمان تشکیل و نمو بلورها ، شرایط مناسب باشد، نطفههای بلور بطور اتفاقی در کنار هم نمیگیرند، بلکه طبق قواعد معین با نظم و ترتیب خاصی با یکدیگر ، رشد و نمو خواهند نمود. صورتهای مختلف اجتماع منظم بلورها عبارتند از:-
اجتماع کروی (اسفرولیتی) :
اگر تبلور ماده مذاب سریع صورت بگیرد و تعداد مراکز تبلور کم باشد، بلورها به شکل سوزنهای باریک و به صورت دستجات کروی و جدا از هم تشکیل میشوند، مانند بلورهای سوزنی شکل طلا و کلرور پتاسیم که در سیستم کوپیک متبلور میشوند. -
اجتماع موازی :
در این گونه تجمع ، بلورها بطور موازی در کنار یکدیگر قرار میگیرند و دارای سطوح مشترکی میباشند. در اجتماع موازی بلورها معمولا بلورهای همجنس شرکت دارند، مانند بلور کوارتز. -
اجتماع بلورهای غیرهمجنس :
علاوه بر بلور همجنس ، بلورهای غیرهمجنس نیز به نوبه خود تشکیل اجتماع منظم و یا جهتدار میدهند. این نوع اجتماعات بر پایه تشکیل نطفه بلوری بر روی بلور دیگری قرار دارد، به نحوی که سطح مشترک بین دو بلور از نظر ساختمان شبکهای مشابه باشند. برای مثال ، اغلب بر روی بلورهای ورقهای هماتیت بلورهای سوزنی شکل روتیل نمو نمودهاند و در پگماتیتها بلورهای کوارتز در داخل بلور ارتوز به صورت اجتماع موازی دیده میشود.
-

اختصاصات مواد متبلور
اجسام متبلور به خاطر داشتن شکل مخصوص ، سختی ، خاصیت ارتجاعی ، مقاومت محدود در مقابل حرارت و فشار و نقطه ذوب از مایعات و گازها متمایز میشوند. بعضی از مواد متبلور مانند پارافین نرم هستند و اجسامی مانند شیشه و پلاستیک هرچند که جامدند، ولی متبلور نمیباشند. بلورها اجسامی همگن و انایزوتوپ هستند. انایزوتوپ بودن بلور به این علت است که اختصاصات فیزیکی مانند سرعت انتشار حرارت و نور یا درجه سختی و غیره در جهات موازی آنها برابر میباشد و در جهات مختلف نابرابر میباشد.
رنگ بلورها
هرگاه بخش اعظم نور از بلور عبور کند و فقط مقدار کمی از آن جذب گردد، بلور شفاف دیده میشود و چنانچه مقدار نور جذب شده و نوری که از بلور عبور میکند، تقریبا برابر باشد، بلور نیمه شفاف به نظر میرسد. در صورتی که اگر تمام نور وارده جذب گردد، بلور تیره دیده میشود. هرگاه جذب نور برای طول موجهای مختلف متفاوت باشد، بلور رنگی بنظر میرسد.
بعضی از بلورها دارای رنگهای مشخص هستند، مثلا مالاکیت دارای رنگ سبز و ازوریت دارای رنگ آبی آسمانی میباشد. تعدادی از بلورها در اصل بیرنگ میباشند، ولی در اثر وجود ناخالصی و یا پیگمان به رنگهای مختلفی دیده میشوند. مثلا کوارتز بیرنگ بوده، ولی در اثر ناخالص دارای رنگهای سفید ، بنفش ، دودی ، زرد ، صورتی و سیاه میباشد و یا وجود کروم به صورت پیگمان در کروندوم باعث رنگ قرمز آن میشود.
برخی از کاربردهای بلورها
-
بلورهای
 و نظایر آنها در ساختن وسایل نوری بکار میروند.
و نظایر آنها در ساختن وسایل نوری بکار میروند. -
بلورهائی با خاصیت پیروالکتریسته مثل
 در صنعت الکترونیک کاربرد دارند.
در صنعت الکترونیک کاربرد دارند. -
بلورهای SiC در تهیه ترانزیستور و روبین یا یاقوت در تهیه اشعه لیزر مورد استفاده قرار میگیرند.
بلورها برحسب نوع ذرات تشکیل دهنده و نیروهای نگه دارنده این ذرات به چهار نوع بلورهای یونی ، مولکولی ، کووالانسی (مشبک) ، فلزی گروه بندی میشوند
تقطیر:
اگر هدف از تقطیر ، جداسازی یک مخلوط به اجزای بالا باشد، از تقطیر ساده برای جداسازی اجزاء استفاده میشود. اما اگر همه اجزاء فرار باشند، از تقطیر جزء به جزء برای جداسازی استفاده میشود. اگر یک مخلوط تولید آزئوتروپ کند، ( مثل آب و الکل) نمیتوان از روش تقطیر جزء به جزء ، اجزای آن را جدا کرد. برای جداسازی این مخلوط از روشهای تقطیر با بخار آب ، تقطیر در خلاء و تقطیر ناگهانی استفاده میکنند.
در تقطیر با بخار آب هیچگاه درجه حرارت تقطیر از نقطه جوش آب بیشتر نمیشود. ترکیباتی نظیر تولوئن ، اتیلن ، گلیسیرین و اسیدهایچرب از این طریق جدا میشوند. برای جلوگیری از تجزیه مایعاتی که دارای نقطه جوش بالایی هستند از تقطیر در خلاء استفاده میشود. با کاهش فشار ، نقطه جوش مایع کاهش پیدا میکند.در تهیه آب آشامیدنی از آب دریا و تهیه آب مقطر نیروگاهها از تقطیر ناگهانی استفاده میشود. در این روش مایع بطور مداوم وارد و بخار بطور مداوم خارج میشود. در شکل زیر تصویر
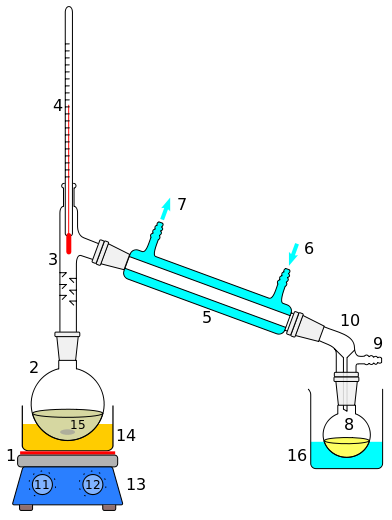
یک دستگاه تقطیر دیده می شود.
تصویری از یک نمومه آزمایشگاهی دستگاه تقطیر: 1: گرمکن 2: بالن تقطیر 3: برج تقطیر 4: دماسنج(برای تعیین دمای جوش) 5: مبرد 6: ورودی آب سرد 7: خروجی آب سرد 8: بالن جمع آوری محصول 9: ورودی گاز یا خلاء 10: جمع آوری کننده بخارات 11: تنظیم کننده حرارت 12: تنظیم کننده سرعت همزن 13: صفحه گرمکن 14: حمام روغن یا شن 15: همزن 16: حمام آب سرد.
رسوب دادن:
نوعی روش جداسازی است که اساس آن اختلاف حلالیت اجسام میباشد. یعنی جزیی که حلالیت کمتری دارد زودتر جدا میشود. با افزایش نیروی جاذبه سرعت تهنشین شدن افزایش پیدا میکند. عمل سانتریفوژ در واقع بر همین اساس است.
سانتریفیوژ (به انگلیسی: Centrifuge) یا دستگاه مرکزگریز دستگاهی است که در آن با استفاده از نیروی گریز از مرکز مواد را از یکدیگر جدا میکنند. در این دستگاه محفظهای که مواد جداشدنی در آن قراردارد معمولاً به کمک یک موتور به سرعت حول یک محور میچرخد.
سانتریفوژ دستگاهی است که از آن برای چرخاندن مواد با سرعت بالا استفاده میشود. دانشمندان معمولاً دستگاه سانتریفوژ را برای جدا کردن ذرات جامد از یک مایع یا تقسیم مخلوط مایعات به اجزای مختلف آن به کار میگیرند. مخلوط را درون لولهای قرار میدهند که طوری قرار داده شدهاست که با چرخش دستگاه، به سمت خارج از مرکز حرکت میکند و به حالت افقی قرار میگیرند. در این حالت، نیروی گریز از مرکز میخواهد که مخلوط را برخلاف مرکز سانتریفوژ براندو از این نقطه دور کند و ذرات یا مایع سنگین تر بیش تر به سمت بیرون (یا ته مخلوط) رانده میشوند. وقتی سانتریفوژ از حرکت باز میایستد، مواد به همین حالت غیر مخلوط میمانند. خون و سایر نمونههای بیولوژیکی را معمولاً به وسیله دستگاه سانتریفوژ جدا میکنند. سریعترین سانتریفوژ با نام «فرامرکز گریز» با سرعت ۲۰۰۰۰۰ دور در دقیقه میچرخد. از دستگاههای گریز از مرکز بزرگ برای انجام آزمایش بر روی خلبانان نظامی و فضانوردان استفاده میشود تا میزان مقاومت آنان در شتابهای بالا معلوم شود.
انواع دستگاه ها
انواع دستگاههای مرکز گریز برای مصارف گوناگون ساخته شدهاست. نمونههای خانگی این دستگاه برای جداکردن آب از سبزیها مثل کاهو و غیره بکار میرود. همچنین در ماشینهای لباسشویی نیز برای خشک کردن لباس استفاده میشود. در نمونههای آزمایشگاهی برای جداکردن گلوبولهایخون از پلاسما استفاده میشود. دستگاههای صنعتی با موتورهای قوی و در ابعاد بزرگ برای جدا کردن مواد بکار میرود. در کار غنیسازی اورانیوم نیز از دستگاههای مرکزگریز گازی استفاده میشود.
اساس کار سانتریفوژها
هر گاه جسمی با سرعت معینی حول یک مرکز با محور دوران کند نیرویی در جسم متحرک و در جهت عمود بر مسیر دوران و به سمت خارج از مرکز ایجاد میگردد. که به نیروی فراگریز یا نیروی گریز از مرکز موسوم است که مقدار آن از رابطه F=MRW2 که در آن R شعاع دوران M جرم جسم و V سرعت خطی و W سرعت زاویهای است بدست میآید. محور دوران ممکن است به سه حال قائم، افقی یا مایل باشد.

استخراج:
اساس این روش ، اختلاف حلالیت یک جزء در دو حلال غیر قابل حل در یکدیگر است. اگر دو حلال غیر قابل استخراج ، مایع باشند، به این روش استخراج مایع ـ مایع گویند و اگر یک جسم جامد به وسیله یک حلال استخراج شود، به آن استخراج جامد ـ مایع گویند (مثل استخراج اسانسها ، عصارهها و روغن از دانههای گیاهی). عموما دو فاز مورد استفاده ، یکی آب است و دیگری یک حلال آلی.مقداری از جسم در فاز آبی و مقداری نیز در فاز آلی میباشد. بازده استخراج با ضریب تقسیم نسبت مستقیم دارد. دوبار استخراج با حجم کمتر از حلال آلی همیشه موثر از یک بار استخراج با حجمی مساوی دو برابر حجم اول است. چون در حالت اول ، مقدار وزن ماده باقیمانده محلول در آب ، کمتر از حالت دوم خواهد بود.
کروماتوگرافی:
اساس کروماتوگرافی ، جذب سطحی مواد و توزیع آنها در دو فاز میباشد. یکی از فازها ثابت و فاز دیگر متحرک است که نمونه مورد نظر در فاز متحرک جدا میشود. فاز ثابت یا جامد است و یا مایع و فاز متحرک یا مایع است و یا گاز . اگر فاز ثابت ، جامد و فاز متحرک ، مایع باشد، به آن کروماتوگرافی مایع ـ جامد LSC ) )گویند. اگر فاز متحرک ، گاز و فاز ثابت ، جامد باشد، به آن کروماتوگرافی گاز - جامد ( GSC ) گویند. اگر فاز متحرک ، مایع و فاز ثابت نیز مایع باشد به آن کروماتوگرافی مایع ـ مایع LLC ) یا( HPLC گویند و در نهایت اگر فاز متحرک ، گاز و فاز ثابت ، مایع باشد، به آن کروماتوگرافی گاز - مایع GLC ) یا (VPC گویند.در LSC ، جدا شدن بر اساس جذب سطحی یا تعریض یونها و یا تشکیل کمپلکس میباشد. در GSC اساس ، جداسازیجذب سطحی است. در LLC و GLC ، مواد بر اساس توزیع بین دو فاز جدا میشوند. پس کروماتوگرافی روشی برای جداسازی مخلوط بدلیل اختلاف تحرک آنها میباشد.کروماتوگرافی LSC در واقع نوعی کروماتوموگرافی جذبی است که مواد بر اساس اختلاف در قابلیت جذب خود روی سطح جامد از یکدیگر جدا میشوند. در GSC نیز اساس جداسازی جذب سطحی فاز گاز روی سطح جامد است. از این روش برای خالص سازی گازها استفاده میشود.
کروماتوگرافی لایه نازک(Thin Layer Chromatography) (TLC)
کروماتوگرافی لایه نازک نوعی کروماتوگرافی جذبی جامد – مایع است و اصول آن مانند کروماتوگرافی ستونی است. ولی در این مورد جسم جاذب جامد را به صورت یک لایه نازک در روی یک قطعه شیشه یا پلاستیک محکم پخش میکنند. یک قطره از محلول نمونه یا مجهول را در نزدیکی لبه صفحه میگذارند و صفحه را همراه مقدار کافی از حلال استخراج کننده در ظرفی قرار میدهند. مقدار حلال باید آنقدر باشد که فقط به سطح زیر لکه برسد (شکل الف). حلال به طرف بالای صفحه میرود و اجزاء مخلوط را با سرعتهای متفاوت با خود میبرد. در نتیجه ممکن است تعدادی لکه روی صفحه ظاهر شود. این لکه ها روی یک خط عمود بر سطح حلال ظرف قرار میگیرند (شکل ب).

این روش کروماتوگرافی بسیار آسان است و به سرعت هم انجام میشود. این روش برای تفکیک اجزاء یک مخلوط بسیار مفید است و همچنین میتوان از آن برای تعیین بهترین حلال استخراج کننده جهت کروماتوگرافی ستونی استفاده کرد.
در TLC میتوان از همان مواد جامد که در کروماتوگرافی ستونی استفاده میشود استفاده کرد و در این میان سیلیکا و آلومینا بیشتر به کار میرود. معمولا جسم جاذب را با مقدار کمی از ماده نگهدارنده مانند گچ شکسته بندی، کلسیم سولفات و یا نشاسته مخلوط میکنند تا جسم جاذب چسبندگی لازم را پیدا کند و به صفحه بچسبد. صفحه ها را میتوان قبل از مصرف تهیه کرد و یا از ورقه های پلاستیکی آماده که در بازار موجود است استفاده نمود.
یکی از مزایای مشخص TLC آن است که احتیاج به مقدار بسیار کمی از نمونه دارد. در بعضی موار میتوان تا مقدار 9-10 گرم را تشخیص داد. اما ممکن است اندازه نمونه تا 500 میکرو گرم برسد. در نمونه های زیاد میتوان از تجربه های تهیه ای استفاده کرد. در این تجربه ها لکه های مختلف را میتراشند و با یک حلال مناسب میشویند (استخراج میکنند). و برای شناسایی (از طریق طیف سنجی) به کار میبرند.
تشخیص لکه های رنگین در روی کروماتوگرام آسان است و برای تعیین محل لکه های اجسام بیرنگ روشهای متعددی وجود دارد. برای مثال میتوان با تابش نور ماوراء بنفش به صفحه محل لکه، ترکیبهایی را که خاصیت فلوئورسانس دارند مشخص کرد. به روش دیگر میتوان جسم جاذب را با ماده فلوئورسانس دار بی اثر دیگری مخلوط کرد. هنگامی که نور ماوراء بنفش به این صفحه بتابد، لکه اجسامی که نور ماورای بنفش را جذب ميکنند ولی خاصیت فلوئورسانس ندارند در زمینه فلورسانس دار صفحه به صورت تیره رنگ ظاهر میشوند. در بسیاری موارد دیگر، از معرفهای آشکارساز دیگری استفاده میکنند. این معرفها را میتوان بر روی کروماتوگرام پاشید و لکه ها را ظاهر کرد. سولفوریک اسید، که بسیاری از ترکیبات آلی را به ذغال تبدیل میکند و محلول پتاسیم پرمنگنات نمونه هایی از معرفهای آشکار ساز هستند که به این روش مصرف میشوند. ید نیز معرف آشکار ساز دیگری است که مصرف میشود. در این مورد صفحه را در ظرفی میگذارند که محیط آن از بخار ید اشباع باشد. بسیاری از ترکیبات آلی ید را جذب میکنند و لکه آنها روی کروماتوگرام رنگین (معمولا قهوه ای) میشود.
در شرایط معین سرعت حرکت ترکیب نسبت به سرعت پیشرفت حلال (Rf) خاصیت مشخصی از ترکیب است. برای تعیین این مقدار مسافتی را که جسم از خط شروع تا وسط لکه را طی کرده است اندازه میگیرند و آنرا به مسافتی که حلال پیموده تقسیم میکنند. این مسافت را با خط شروع یکسانی میسنجند.
بخش عملی
تفکیک مواد رنگی برگ سبز
چند میلی لیتر از مخلوط 2 به یک اتر نفت و اتانول را همراه با چند برگ سبز در هاونی بگذارید و برگها را با دسته هاون له کنید. مایع بدست آمده را به یک قیف جدا کننده منتقل کنید و همان حجم آب مقطر به آن اضافه کنید و تکان دهید. فاز آبی پایینی را دور بریزید. این شستشو را دو بار انجام دهید و هر بار فاز آبی را دور بریزید. و آب تازه اضافه کنید.لایه آلی (بالایی) را به ارلن کوچکی منتقل کنید و به آن 2 گرم سدیم سولفات بدون آب اضافه کنید (برای آب گیری).
یک نوار 10 سانتی از ورقه کروماتوگرام سیلیکاژل تهیه کنید و یک لکه 1 الی 2 میلی متری از محلول ماده رنگی را طوری بر روی صفحه قرار دهید که حدود 1 و نیم سانتی متر از انتهای آن فاصله داشته باشد (برای گذاشتن لکه از لوله مویین تمیز استفاده کنید). صبر کنید تا لکه خشک شود. برای جداسازی، از حلال بنزن – استون با نسبت 7 – 3 (حجمی) مطابق توضیحات بالا استفاده کنید.
ممکن است تا هشت لکه رنگین مشاهده شود. این لکه ها به ترتیب کاهش مقدار Rf عبارتند از کاروتنها (دو لکه نارنجی)، کلروفیل a (آبی – سبز)، کلروفیل b (سبز) و زانتوفیلها (چهار لکه زرد).
تعداد صفحات : 1